
李長青博士 埃格林醫藥CMO
“僅僅是比較腫瘤切塊,同一個動物模型里,雙藥治療后的平均腫瘤重量約為730毫克,而我們的三藥治療方案只剩下300多毫克。”對話中,李長青有些興奮地向寫意君分享,“這非常直觀展示了EG-007組合的效果。”
EG-007是李長青加入埃格林醫藥后領導的首個候選藥物。7月中旬,李長青出任埃格林醫藥CMO一職。隨后的8月,經過兩次pre-IND meeting,EG-007與靶向藥物、抗PD-1抗體類藥物聯用治療晚期子宮內膜癌的III期關鍵性臨床試驗方案,得到FDA的同意。
值得注意是,被視為腫瘤治療中的“黑馬”——帕博利珠單抗(K藥)與侖伐替尼(Lenvatinib)這一“可樂組合”,不久前剛拿到了FDA的完全批準,用于治療晚期非微衛星高度不穩定(MSI-H)或錯配修復缺陷(dMMR)子宮內膜癌患者。
“可樂組合”雖然尚未在國內獲批,中國臨床腫瘤協會,尤其是子宮內膜癌治療準則已有所關注。李長青稱,III期關鍵試驗正在進行中,組合中的單藥卻分別在中國上市,實踐中不存在聯合使用的門檻。這也意味著,“可樂組合”把子宮內膜癌的治療推向新高,成為全球該領域的“standard of care”。
因此,EG-007要做的事情,屬于直接挑戰新標準治療的III期“頭對頭”。埃格林醫藥為EG-007設計的是優效試驗,不但統計學上有意義,在臨床上也要有意義。
“大家可能有個誤區,最先聽到一個候選藥物直接進入III期臨床,覺得很厲害;再看這個產品原來是‘老藥’,就覺得沒什么亮點。”李長青解釋道,“實際上,‘老藥’也不是全都能直接進III期。FDA更看重一個項目背后的臨床價值。”
進入工業界前,李長青曾在FDA擔任高級醫學審評官,也是中國大陸留學人員以醫生身份進入FDA臨床審評的第一人。對FDA法規的熟稔,加之多年的評審經驗,使李長青在主導推進EG-007項目時更加得心應手。
除了李長青之外,埃格林醫藥高管中,董事長杜濤、CEO杜新,以及具體參與到EG-007項目的藥理學總監胡濤,都曾在FDA有過從業經歷。正是這些標簽,讓埃格林醫藥區別于大部分biotech公司。
“我們正在探索一個新的方法論,一條能提高臨床價值的道路。”這是李長青對EG-007項目的期望。換言之,EG-007在子宮內膜癌的初步成功,只是埃格林醫藥的一小步。一旦“老藥新用”(drug repurpose)模式走通,埃格林醫藥有望迅速在其他適應癥和管線上實現復刻,推動成果落地與上市。
“老”“新”之辯:提高臨床價值方為王道
2018年,港股“18A”新政落地,國內迎來一波未獲盈利的biotech公司IPO熱潮。隨后科創板開閘,進一步促成生物醫藥本土創新的風尚,first in class、best in class等話題,亦頻頻占據行業討論焦點。
可問題在于,first in class似乎仍是個未能完全達成行業共識的概念。大量標榜first in class的項目在為數不多的細分賽道扎堆,將國內的創新環境帶向泡沫橫飛的境況。
7月,CDE發布《以臨床價值為導向的抗腫瘤藥物臨床研發指導原則》征求意見稿,便是對創新亂象的一次矯正。“從我們角度來講,first in class、best in class如果能夠做成,當然也是很好的。”李長青回應說,“不過,這(些概念)只是表層。一個藥物能否獲批,或則應不應該給予相應的政策支持,本質上要看它是不是帶來新的臨床價值,即解決“未滿足的臨床需求。”
以FDA為例,目前已開通的優先審評、快速通道、突破性療法以及加速審批等特別通道,核心目的是對潛在提高患者獲益的藥物,從開發到上市的不同階段提供支持。“可樂組合”就曾因Study 111/KEYNOTE-146研究中子宮內膜癌隊列的良好的中期結果,在2018年被FDA授予突破性療法認定。
細看“可樂組合”的作用機制,K藥主要阻斷PD-1免疫逃逸通路,而侖伐替尼則通過競爭性抑制VEGF和相應受體結合,抑制腫瘤細胞和TAM的生長分化——無論是其中哪一個,此前已都有不少成熟的研究。
“如果用嚴格的標準,已經上市批準的藥都可以算作‘老藥’,那么即使被譽為‘抗癌神藥’的PD-1單抗,也屬于‘老藥’。然而,這并不是影響它的后續開發,只要能夠獲益的適應癥、組合,都是藥監部門所歡迎的。”李長青舉例說。
不僅國際藥企日漸重視“老藥新用”的創新策略,NIH等研究機構也將之視為戰略布局領域。在過去的十余年中,NIH以不同方式多次指出,希望通過測試治療不同疾病的已獲批準的藥物,來幫助加快藥物的開發和削減成本。

老藥新用開發時間,費用和專利保護
比較研發成本數據,一款新藥上市大概耗費10年時間,投入約10億美元,但成功率只有10%。甚至在抗腫瘤領域,成功率不到4%。“老藥新用”則更加誘人,不但省時(6年)省錢(3億美元),成功率還高(25%)。
提高臨床價值并不局限于療效的改善,很大程度上,也要看患者的負擔情況。形象地理解,“老藥新用”一端抬升了成功率,另一端拉低了研發成本,最終有助于“藥好價廉”的多贏局面。
同時,“老藥新用”也受到很嚴密的專利保護。無論是在中國還是在歐美國家,如果一個老藥經過研究,發現了新的用途,可以申請獲得“新用途專利”。而“新用途專利”屬于是保護力度很強和保護范圍很廣的發明專利。因此,“老藥新用”是國際上醫藥工業的一種新趨勢。
“把‘老藥新用’這個看起來普通的事情做到極致,這是我們的信念。”李長青將“極致”形容為“在巨人頭上給皇冠做珠子”,EG-007項目便是上述信念的實踐。由于只需要開展一項III期臨床,并且組合里都是獲批的“老藥”,省去了額外證明單藥有效性的環節,李長青稱,這為埃格林醫藥節省了六成的費用和時間。
埃格林醫藥的三藥組合,核心仍舊圍繞著改善腫瘤內部微環境(TME),借助不同的機制協同,把“冷腫瘤”變為“熱腫瘤”,增加組織里的T細胞侵潤,以強化殺傷腫瘤的效果。這是我們的藥物對聯合使用和作用機制的關鍵貢獻. 援引李長青給到的另一組數據,埃格林醫藥的三藥組合對動物模型腫瘤的抑制達到86%,而“可樂組合”是75%,單藥治療(Anti-PD1 antibody)的數據為69%。
02
對標“可樂組合”,EG-007翻越“三座大山”
直接快速進入III期臨床,選擇當前最佳組合切入,“頭對頭”的用藥價值定位——套用李長青的說法,EG-007項目從一開始就按照“硬核”模式來推進。
以成立時間起算,當前埃格林醫藥剛剛過完了成立兩周年的生日。但必須指出,上述理念并非國內生物醫藥創新窗口與資本市場風口迅速變小下的孤注一擲。相反,EG-007已經是埃格林醫藥第四個進入臨床開發階段的候選藥物。
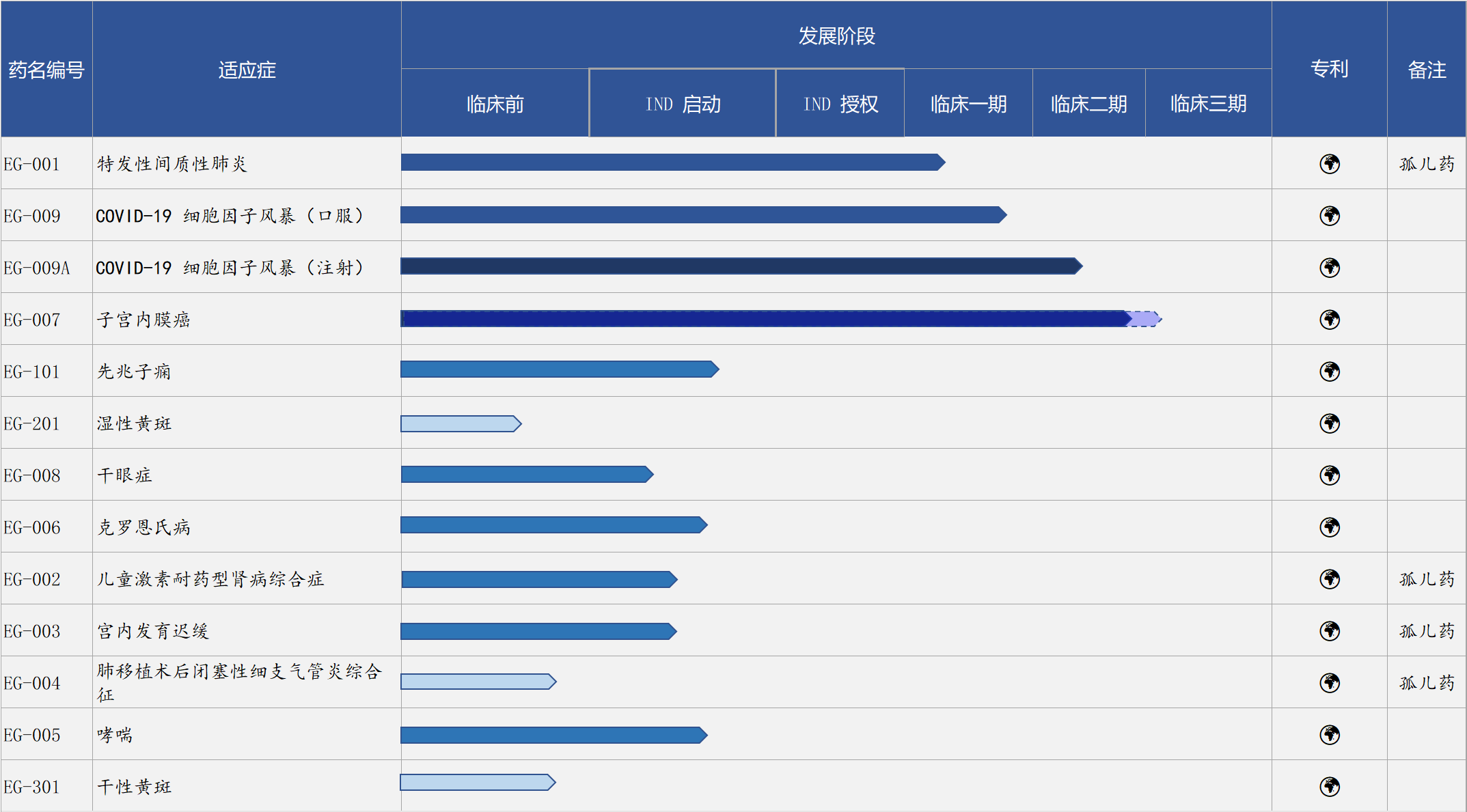
埃格林醫藥研發管線
不過,EG-007最初申請的是小規模的II期臨床,達到一定的臨床終點后,將其作為III期臨床的部分資料,繼續開發研究。
“我們制定了一個‘燈芯戰略’,就像點燃蠟燭需要一根引線,我們在臨床方案上,設計了一個類似‘燈芯’的小部分,小到只需要二三十個病人的II期臨床。把這個‘燈芯’點燃后,我們就一鼓作氣進入五六百人規模的III期臨床。”李長青解釋說。
考慮到子宮內膜癌的治療需求與現有藥物的應答率水平,在正式溝通時,FDA提出另一個方案,讓EG-007跳過II期直接進入III期,所以才有了少見的第二次pre-IND meeting。“最終能夠完成與FDA的順利溝通,還得靠團隊的法規背景積累。”李長青進一步補充,“FDA的政策在哪個地方彈性大,哪地方彈性小,這個判斷力是非常重要。”
子宮內膜癌屬于子宮內最常見的癌癥類型,也是全球女性第六大癌癥。數據顯示,2020年全球有超41.7萬新確診病例和9.7萬死亡病例。“可樂組合”的出現,給子宮內膜癌患者提供更多的希望,也讓埃格林醫藥看到對標的方向。
“EG-007項目基于腫瘤微環境去開發,選組合的時候,我們對相關療法進行全面分析,最終把視線落在‘可樂組合’上。對于腫瘤免疫聯合治療,它應該算是數一數二,目前已布局14個適應癥,包括EG-007就有過探索的子宮內膜癌。”李長青對寫意君講述項目思路,“這個領域獲批的新藥還很少,療效也有很大提升空間。所以,我們希望站在巨人肩上做得更好”
對比化療組,“可樂組合”治療子宮內膜癌患者的客觀緩解率(ORR)增長了一倍,但也只是30%。隨之而來的問題是,埃格林醫藥的三藥組合,應該從“可樂組合”無法覆蓋的70%患者入手,還是直接與它“頭對頭”?
“這實際上涉及到藥物的臨床定位,到底是做一線、二線還是三線治療。”李長青認為,結合既往研究,EG-007項目可以直接在首選治療方案上與“可樂組合”展開較量。
眾所周知,針對所謂的“treatment failure”進行治療,是不少臨床試驗的常規方式。畢竟機理沒有很大改變,增加新的藥物改善腫瘤微環境,或許能提升組合療效。然而,倘若組合并不成功,情況就更為復雜:可能是源自微環境的改善不夠,也可能是患者出現阻抗問題,甚至還包括其他未知影響因素。
另一廂,李長青也表示,從動物模型角度看,如何找到經治療失敗的動物,增加新的候選藥物以進行MOA驗證,同樣存在一定難度。“所以我們覺得,‘頭對頭’一線治療確實有風險,但綜合起來,這反而是更合理的選擇。”李長青總結道。
埃格林醫藥計劃,EG-007項目會在100個以上臨床試驗點開展III期臨床,覆蓋10個以上國家和地區。在美國拿到IND后,針對歐洲、日本、中國等主要藥物市場的臨床申報也逐步提上日程。
“我們正在和多家CRO溝通,針對此次臨床的推進展開合作。樂觀估計,力爭在3年內完成關鍵性III期試驗,并在全球范圍內提交新藥申請。”李長青最后提及。
屆時,埃格林醫藥從“first in disease”(新的適應癥),到“first in treatment choice”(新的一線治療),再到“first in patient choice”(滿足患者的選擇需求)的方法論,將獲得堅實的案例背書。
文章轉自同寫意,如有侵權,請聯系深圳埃格林醫藥有限公司刪除。